0. 이전 이야기
저번 포스팅에서는 엔탈피에 대해서 학습함
엔탈피란 일정한 압력하에서 열의 변화를 설명하기 위핸 개념
등압과정에서 열의 변화 ≠ 내부에너지 변화 이므로 새로운 정의를 한 것
이전 글
https://nate0707.tistory.com/72
【물리화학1】 2-2 엔탈피
2-1 내부에너지에서는 고립계의 총 에너지가 일정하다는 열역학 제 1법칙에 대해 포스팅하였음https://nate0707.tistory.com/71 【물리화학1】 2-1 내부 에너지열역학 제 1법칙 : 고립계의 총 에너지는 일
nate0707.tistory.com
이번 포스팅에서는 여러 화학 반응 과정에서 열로서 이전되는 에너지로 인한 엔탈피 변화와 실험 기법을 통한 열 계량에 대해 설명한 것임
이때 계에서 주위로 에너지가 방출되는 발열 과정 : $\Delta H<0$
주위에서 계로 에너지가 흡수되는 흡열 과정 : $\Delta H>0$
1. 표준 엔탈피 변화
주로 우리의 실제 상황과 맞는 표준 상태에서의 변화를 이용해 엔탈피의 변화를 구함
* 표준 상태는 1bar의 압력 하에서의 순수한 상태를 말함
표준 엔탈피 변화는 표준 상태에 있는 생성물들과 반응물들의 엔탈피 차이로 구함
표준 엔탈피는 어느 온도에서나 정의될 수 있지만, 관습적으로 298.15K (25℃)을 이용함
- 물리적 변화의 엔탈피
# 표준 전이 엔탈피
물리적 상태 변화에 수반되는 표준 엔탈피 변화를 표준 전이 엔탈피라고 부르며 $\Delta_{trs} H^ {\Theta} $로 표시함
그 예로 표준 증발 엔탈피인 $\Delta_{vap} H^{\Theta}$ 가 있음
$H_2O(s)→H_2O(l)$ $\Delta_{fus} H^{\Theta} (273K)=+6.01KJmol^{-1}$
이러한 표준 전이 엔탈피의 경우 관습 온도 뿐 아니라 전이 온도에서의 값을 알면 편리함
# 엔탈피는 상태함수
상태함수는 두 상태 사이의 변화 경로에 무관함
즉, 변화를 어떻게 일으키든 처음과 최종의 상태만 중요하다는 것임

위의 그래프에서 알 수 있듯이 다음 식이 성립함(동일한 온도에서 일어날 경우)
$\Delta_{sub} H^ {\Theta}$ $=\Delta_{fus} H^{\Theta}+$ $\Delta_{vap} H^ {\Theta}$
또한 엔탈피가 상태함수이기 때문에 정뱡향 과정과 역방향의 표준 엔탈피 변화가 크기는 같고 부호만 다르다는 것을 알 수 있음
$\Delta_{fus} H^ {\Theta}(A→B)=-\Delta_{fus} H^ {\Theta}(B→A)$
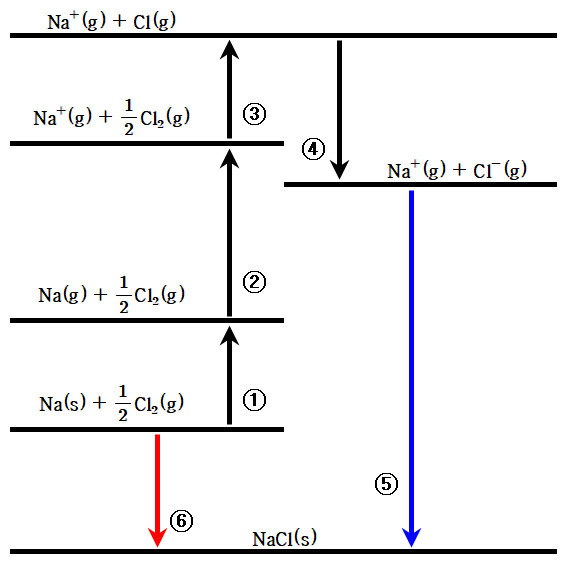
# 격자 엔탈피와 Born-Harber 순환
고체가 증발하려면 에너지가 크게 증가해야만 하는데, 특히 이온들로 된 고체의 경우 이온들 사이의 센 쿨롱 상호작용을 이겨내야함
$MX(s)→M^+(g)+X^-(g)$
이 과정에서의 표준 몰 엔탈피 변화를 격자 엔탈피 $\Delta H_L$ 이라 부름
이는 T=0에서의 격자 내부 에너지와 동일함
이러한 격자엔탈피는 Born-Haber 순환을 이용해 실험적으로 얻을 수 있음
- 화학 변화의 엔탈피
화학 반응에 수반되는 엔탈피 변화는 열화학 반응식을 이용하는 방법과 이를 쓴 후 표준 반응 엔탈피를 이용하는 방법 두가지로 나타냄
# 열화학 반응식을 이용
표준 상태에서 혼합되지 않은 순수한 상태의 반응물로부터 표준상태에 있는 생성물이 생길 때 엔탈피의 변화
$CH_4(g)+2O_2(g)→CO_2(g)+2H_2O(g)$ $\Delta H^ {\Theta}=-890KJ$
# 표준 반응 엔탈피를 이용
이는 화학 반응식을 쓴 후 표준 반응 엔탈피 $\Delta_r H^ {\Theta}$ 를 나타내는 것임
$2A+B→3C+D$와 같은 꼴의 경우 표준 반응 엔탈피는 다음과 같음
$\Delta_r H^ {\Theta}={3\Delta_m H^ {\Theta}(C)+\Delta_m H^ {\Theta}(D)}-{2\Delta_m H^ {\Theta}(A)+\Delta_m H^ {\Theta}(B)}$
이를 정리하면 다음과 같이 나타냄
$\Delta_r H^ {\Theta}= \sum_{products} {vH_{m}^ {\Theta}} - \sum_{reactants} {vH_{m}^ {\Theta}}$
여기서 각 항들은 몰 엔탈피를 의미하며 해당하는 화학량을 계수 v를 곱한 것임
- Hess의 법칙
Hess의 법칙이란 한 반응을 일련의 여러 반응 성분으로 분해시켰을 때, 이들 성분 반응들의 표준 반응 엔탈피들을 합하면 그 전체 반응의 표준 반응 엔탈피가 된다는 것임
* 이러한 이유는 엔탈피가 상태함수 state function이기 때문임
* 이를 통해 직접 측정하기 어려운 반응에 대한 지식을 다른 반응을 통해 구할 수 있음
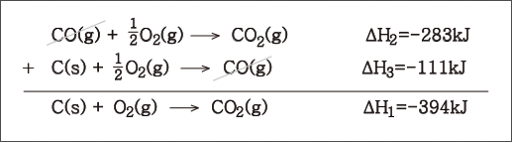
이는 앞서 구한 표준 전이 엔탈피의 성질에도 적용됨 $\Delta H_{fus}+\Delta H_{vap}=\Delta H_{sub}$
2. 표준 생성 엔탈피
표준 생성 엔탈피 $\Delta_f H^{\Theta}$ (standard enthalpies of formation)는 기준 상태에 있는 성분 원소들로부터 화합물이 생성될 때의 표준 반응 엔탈피를 말함
* 원소의 기준상태란 명시된 온도와 1bar의 압력 하에서 가장 안정한 상태를 말함
기준 상태에 있는 원소의 표준 생성 엔탈피는 모든 온도에서 0임
$N_2(g)→N_2(g)$
# 이온의 표준 생성 엔탈피
용액 속에는 양이온만 들어있거나 음이온만 온전히 들어있을 수 없으므로 표준 생성 엔탈피를 정의하기 어려움
이를 위해 한 특정한 이온(관습적으로 수소이온)의 표준 생성 엔탈피를 모든 온도에서 0으로 약속함
$\Delta_f H^{\Theta}(H^+,aq)=0$
*어차피 변화하는 $\Delta$값을 구하고 싶은 것이기 때문에 위와같이 사용함
- 생성 엔탈피로 나타낸 반응 엔탈피
반응물이 생성물이 되는 과정의 엔탈피 변화 = 반응물이 원소로 분해되었다가 생성물이 되는 과정의 엔탈피 변화
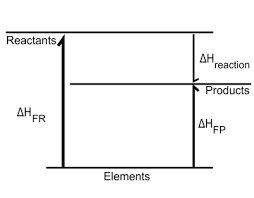
따라서 표준 생성 엔탈피(원소→생성물, 원소→반응물)를 이용해서 임의의 반응의 엔탈피 변화를 구할 수 있음
$\Delta_r H^ {\Theta}= \sum_{products} {v\Delta_f H^ {\Theta}} - \sum_{reactants} {v\Delta_f H^ {\Theta}}$
각 항들의 종은 생성 엔탈피에 화학량적 계수를 곱한 것임
- 생성 엔탈피와 분자의 모형 설계
이는 생성 엔탈피로 반응 엔탈피를 나타내는 것으로부터 영감을 얻은 설계임
화학종의 성분(개개 원자와 결합들의 기여)을 가지고 표준 생성 엔탈피를 구하는 방식임
$A─B(g)→A(g)+B(g)$ $\Delta H(A─B)$
3. 반응 엔탈피의 온도 의존
기존에 표준 반응 엔탈피를 통해 하나의 화학식의 엔탈피를 구했음
이번에는 어느 한 온도에서의 열용량과 반응 엔탈피로부터 임의의 온도에서의 표준 반응 엔탈피를 계산할 것임
온도가 상승하면 생성물과 반응물의 엔탈피가 모두 증가하지만 그 정도는 다름
각각의 엔탈피 변화는 그 물질들의 열용량에 의존하며 반응 엔탈피의 변화가 이를 반영함
$dH=C_pdT$
$H(T_2)$ $=H(T_1)$ $+\int_{T_1}^{T_2}{C_pdT}$
* 이 때의 온도 영역에서 상 변화가 일어나지 않는다고 가정
# Kirchhoff의 법칙
위의 식은 반응에 관여하는 모든 물질의 엔탈피에 적용되며 따라서 표준 반응 엔탈피에서도 적용 가능함
$\Delta_r H^{\Theta}(T_2)=\Delta_r H^{\Theta}(T_1)+\int_{T_1}^{T_2} {\Delta_r C_p^{\Theta}dT}$
$\Delta_r$ $ C_{p,m}^{\Theta}$ $=\sum_{products} {vC_{p.m}^ {\Theta}}$ $ - \sum_{reactants} {vC_{p,m}^ {\Theta}}$
4. 실험 기법
- 시차 주사식 열 계량
시차 주사식 열량계(DSC, differential scanning calorimeter)는 시료물질과 기준물질을 동시에 냉각 혹은 가열하여 시료의 열 출입을 측정하는 방법
- 등온 적정 열 계량
등온 적정 열 계량법(ITC, isothermal titration calorimetry)은 시료의 열적 성질을 기준 물질의 열적 성질과 비교하는 시차식 방법
'공부 > 【물리화학1】' 카테고리의 다른 글
| 【물리화학1】 2-5 단열 변화 (4) | 2024.09.07 |
|---|---|
| 【물리화학1】 2-4 상태 함수와 완전 미분 (0) | 2024.09.07 |
| 【물리화학1】 2-2 엔탈피 (8) | 2024.09.04 |
| 【물리화학1】 2-1 내부 에너지 (4) | 2024.09.03 |
| 【물리화학1】 2장 열역학 제 1법칙 (2) | 2024.09.03 |