0. 이전 이야기
2-1 내부에너지에서는 고립계의 총 에너지가 일정하다는 열역학 제 1법칙에 대해 포스팅하였음
https://nate0707.tistory.com/71
【물리화학1】 2-1 내부 에너지
열역학 제 1법칙 : 고립계의 총 에너지는 일정하다 1. 일, 열, 및 에너지 - 기초 정의 # 계와 주위 계 (system) : 우리가 관심을 갖는 부분주위 (surrounding) : 계 밖의 나머지 부분 # 여러가지 계 열린
nate0707.tistory.com
여기서 $\Delta U=q+w$이며 내부에너지 변화량은 등온 과정일 때 0임
* 온도의 변화가 없어 분자의 운동에너지는 변함이 없지만, 받은 열로 부피가 변하면 압력도 변함
단열 과정의 경우 내부에너지는 부피의 변화에 의해 변화하며 부피가 증가할 때 내부에너지가 감소함
등압 과정의 경우 압력이 일정하게 유지되는 과정으로 부피가 변하며 내부에너지도 변화함
이때 등적 과정의 경우 w=0이고 $\Delta U=q$임
등적 과정을 이용해 $\Delta U=q_V$를 도출해내고 일정-부피에서의 열용량 $C_V$를 구함
1. 엔탈피의 정의
- 엔탈피를 정의한 이유
여기서 내부에너지는 $\Delta U=q+w$ 인데, 일반적인 상황인 등압과정의 경우 계가 팽창 및 수축을 할 때 계의 부피가 자유롭게 변할 수 있고 이때 계의 내부에너지가 열로서 가해준 에너지와 같지 않음
$\Delta U≠q$
즉 이러한 상황에서 일정한 압력에서 이전된 열을 설명하기 위해 엔탈피 H가 정의됨
$H=U+pV$ 이고 단위는 J,KJ을 사용함
이때 U, p, V 모두 상태함수이므로 엔탈피 H도 상태함수임
- 엔탈피 변화
# 내부에너지 식을 통한 엔탈피를 유도
$\Delta U=q+w$ 이고 $w=-p\Delta V$
$H=q=\Delta U-p\Delta V$
일정 압력의 경로에 따라 계가 두 상태 i와 f 사이의 변화를 일으킬 때 엔탈피
$\int_i^f dH= \int_i^f {dq_p}$
$\Delta H=q_p$
- 열 계량
열 계량을 통해 엔탈피를 구할때는 일정한 압력 하에서 일어나는 과정을 연구하는데 용이한 등압 열량계를 이용함
그 중 대기 쪽으로 열려있는 단열 용기를 많이 사용함
# 응축 상과 기체 상의 열 계량
또한 내부에너지를 구할 때 사용한 반응통 열량계를 이용하기도 하는데, 고체나 액체의 경우 몰 부피가 작아 이들의 $pV_m$값이 작아 엔탈피 H와 내부에너지 U값이 거의 비슷함
하지만 이는 오차가 있을 수 있으며 가장 정밀한 방법은 시차 주사식 열량계(DSC)임
기체 상의 경우 엔탈피 정의 H에 $pV=nRT$를 이용해 엔탈피를 구할 수 있음
$\Delta H=\Delta U+\Delta n_gRT$
2. 엔탈피의 온도에 따른 변화
- 일정 압력에서의 열용량
열용량은 $C= \frac{dq}{dT}$이고, 이때 일정-압력의 조건에서의 열용량 $C_p$는 다음과 같음
$C_p=( \frac{ \partial H}{ \partial T} )_p$
# 열용량의 크기 성질과 세기 성질
일정-부피 열용량과 같이 $C_p$는 1g과 100g이 열용량이 100배 차이나는 크기성질 이며
일정-압력 몰 열용량 $C_{p,m}$은 물질 1mol의 열용량으로 세기 성질임
# 엔탈피와 온도의 관계와 그래프
이러한 일정-압력 열용량은 엔탈피 변화와 온도 변화 사이의 관계를 나타냄
$dH=C_pdT$
$\Delta H= \int_{T_1}^{T_2}{C_pdT} =C_p\Delta T$
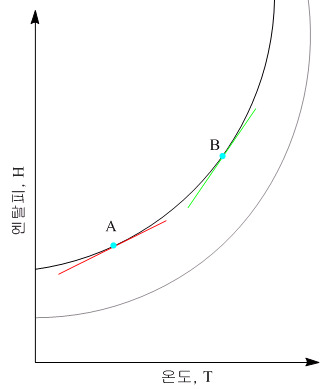
이 그래프의 접선이 그 부분의 열용량 $C_p$를 의미함
# 열용량의 근사
온도 영역이 좁을 경우 온도에 따르는 열용량의 변화를 무시하고 상수취급하여 계산할 수 있음
특히 1원자 완전 기체 $Ne,Ar$등은 이 근사가 매우 잘 맞음
$C_{p,m}=a+bT+\frac{c}{T^2}$
이때 a, b, c는 실험으로 구하는 변수
- 열용량들 사이의 관계
2-1 내부에너지에서 배웠던 일정-부피 열용량과 이번 포스팅의 주제인 일정-압력 열용량을 비교하면 다음과 같음
$C_p-C_v=nR$
* 단원자 이상기체의 경우 $C_v= \frac{3}{2}R$이므로 $C_p= \frac{5}{2}R$이고, $H=\frac{5}{2}RT$
계는 일정한 압력 하에서 가열 시 팽창(일)을 하여 열 에너지가 팽창일로 주위로 되돌아감
즉, 계의 온도가 일정한 부피 하에서 가열할 때보다 덜 올라가고 이는 열용량이 크다는(=같은 열을 가했을 때 온도 변화가 작다) 의미
'공부 > 【물리화학1】' 카테고리의 다른 글
| 【물리화학1】 2-4 상태 함수와 완전 미분 (0) | 2024.09.07 |
|---|---|
| 【물리화학1】 2-3 열화학 (0) | 2024.09.05 |
| 【물리화학1】 2-1 내부 에너지 (5) | 2024.09.03 |
| 【물리화학1】 2장 열역학 제 1법칙 (2) | 2024.09.03 |
| 【물리화학1】 1장 기체의 성질 목차 (0) | 2024.08.09 |
0. 이전 이야기
2-1 내부에너지에서는 고립계의 총 에너지가 일정하다는 열역학 제 1법칙에 대해 포스팅하였음
https://nate0707.tistory.com/71
【물리화학1】 2-1 내부 에너지
열역학 제 1법칙 : 고립계의 총 에너지는 일정하다 1. 일, 열, 및 에너지 - 기초 정의 # 계와 주위 계 systemsystem : 우리가 관심을 갖는 부분주위 surroundingsurrounding : 계 밖의 나머지 부분 # 여러가지 계 열린
nate0707.tistory.com
여기서 ΔU=q+wΔU=q+w이며 내부에너지 변화량은 등온 과정일 때 0임
* 온도의 변화가 없어 분자의 운동에너지는 변함이 없지만, 받은 열로 부피가 변하면 압력도 변함
단열 과정의 경우 내부에너지는 부피의 변화에 의해 변화하며 부피가 증가할 때 내부에너지가 감소함
등압 과정의 경우 압력이 일정하게 유지되는 과정으로 부피가 변하며 내부에너지도 변화함
이때 등적 과정의 경우 w=0이고 ΔU=qΔU=q임
등적 과정을 이용해 ΔU=qVΔU=qV를 도출해내고 일정-부피에서의 열용량 CVCV를 구함
1. 엔탈피의 정의
- 엔탈피를 정의한 이유
여기서 내부에너지는 ΔU=q+wΔU=q+w 인데, 일반적인 상황인 등압과정의 경우 계가 팽창 및 수축을 할 때 계의 부피가 자유롭게 변할 수 있고 이때 계의 내부에너지가 열로서 가해준 에너지와 같지 않음
ΔU≠qΔU≠q
즉 이러한 상황에서 일정한 압력에서 이전된 열을 설명하기 위해 엔탈피 H가 정의됨
H=U+pVH=U+pV 이고 단위는 J,KJ을 사용함
이때 U, p, V 모두 상태함수이므로 엔탈피 H도 상태함수임
- 엔탈피 변화
# 내부에너지 식을 통한 엔탈피를 유도
ΔU=q+wΔU=q+w 이고 w=−pΔVw=−pΔV
H=q=ΔU−pΔVH=q=ΔU−pΔV
일정 압력의 경로에 따라 계가 두 상태 i와 f 사이의 변화를 일으킬 때 엔탈피
∫fidH=∫fidqp∫fidH=∫fidqp
ΔH=qpΔH=qp
- 열 계량
열 계량을 통해 엔탈피를 구할때는 일정한 압력 하에서 일어나는 과정을 연구하는데 용이한 등압 열량계를 이용함
그 중 대기 쪽으로 열려있는 단열 용기를 많이 사용함
# 응축 상과 기체 상의 열 계량
또한 내부에너지를 구할 때 사용한 반응통 열량계를 이용하기도 하는데, 고체나 액체의 경우 몰 부피가 작아 이들의 pVmpVm값이 작아 엔탈피 H와 내부에너지 U값이 거의 비슷함
하지만 이는 오차가 있을 수 있으며 가장 정밀한 방법은 시차 주사식 열량계DSCDSC임
기체 상의 경우 엔탈피 정의 H에 pV=nRTpV=nRT를 이용해 엔탈피를 구할 수 있음
ΔH=ΔU+ΔngRTΔH=ΔU+ΔngRT
2. 엔탈피의 온도에 따른 변화
- 일정 압력에서의 열용량
열용량은 C=dqdTC=dqdT이고, 이때 일정-압력의 조건에서의 열용량 CpCp는 다음과 같음
Cp=(∂H∂T)pCp=(∂H∂T)p
# 열용량의 크기 성질과 세기 성질
일정-부피 열용량과 같이 CpCp는 1g과 100g이 열용량이 100배 차이나는 크기성질 이며
일정-압력 몰 열용량 Cp,mCp,m은 물질 1mol의 열용량으로 세기 성질임
# 엔탈피와 온도의 관계와 그래프
이러한 일정-압력 열용량은 엔탈피 변화와 온도 변화 사이의 관계를 나타냄
dH=CpdTdH=CpdT
ΔH=∫T2T1CpdT=CpΔTΔH=∫T2T1CpdT=CpΔT

이 그래프의 접선이 그 부분의 열용량 CpCp를 의미함
# 열용량의 근사
온도 영역이 좁을 경우 온도에 따르는 열용량의 변화를 무시하고 상수취급하여 계산할 수 있음
특히 1원자 완전 기체 Ne,ArNe,Ar등은 이 근사가 매우 잘 맞음
Cp,m=a+bT+cT2Cp,m=a+bT+cT2
이때 a, b, c는 실험으로 구하는 변수
- 열용량들 사이의 관계
2-1 내부에너지에서 배웠던 일정-부피 열용량과 이번 포스팅의 주제인 일정-압력 열용량을 비교하면 다음과 같음
Cp−Cv=nRCp−Cv=nR
* 단원자 이상기체의 경우 Cv=32RCv=32R이므로 $C_p= \frac{5}{2}R이고,이고,H=\frac{5}{2}RT$
계는 일정한 압력 하에서 가열 시 팽창일일을 하여 열 에너지가 팽창일로 주위로 되돌아감
즉, 계의 온도가 일정한 부피 하에서 가열할 때보다 덜 올라가고 이는 열용량이 크다는=같은열을가했을때온도변화가작다=같은열을가했을때온도변화가작다 의미
'공부 > 【물리화학1】' 카테고리의 다른 글
| 【물리화학1】 2-4 상태 함수와 완전 미분 0 | 2024.09.07 |
|---|---|
| 【물리화학1】 2-3 열화학 0 | 2024.09.05 |
| 【물리화학1】 2-1 내부 에너지 5 | 2024.09.03 |
| 【물리화학1】 2장 열역학 제 1법칙 2 | 2024.09.03 |
| 【물리화학1】 1장 기체의 성질 목차 0 | 2024.08.09 |