- 현열 : 상태는 변하지 않고 온도만 변화할 때 발생하는 열
Q=Cmt
- 잠열 : 온도는 변하지 않고 상태만 변화할 때 필요한 열량
Q=rm
r은 상수
물의 증발 잠열 : 539cal/g
열음의 융해잠열 : 80cal/g
- 삼투압
PV=nRT
n=W/M
PM=dRT
P=dRT/M
- 보일-샤를 법칙: 기체가 차지하는 부피는 압력에 반비례하고 절대온도에 비례함
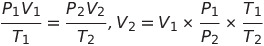
- 그레이엄의 확산속도 법칙 : 확산속도는 분자량의 제곱근에 반비례하고, 밀도의 제곱근에 반비례함
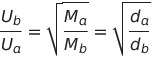
- 열역학 제2 법칙 : 엔트로피는 증가함
- α붕괴 : 헬륨(He)의 원자핵으로 원자번호 2 감소, 질량수는 4 감소
- 𝜷 붕괴 : 중성자가 양성자로 변하면서 전자가 튀어나오는 현상 원자번호 1증가, 질량수 변화 없음
- ϒ붕괴 :방사선의 파장이 가장 짧고 투과력과 방출속도가 가장 큼
- 단원자 분자 : 한 개의 원자를 포함하고 있는 분자(0족 원소)
0족 원소로는 He(헬륨), Ne(네온), Ar(아르곤), Kr(크립톤), Xe(크세논), Rn(라돈) 등이 있음
- 당량(equivalent, eq) = 수소 원자 1 g 또는 산소 원자 8 g 또는 염소 원자 35.5 g과 반응하는 양
당량=원자량/원자가
- 산의 성질
수용액은 초산과 같이 신맛이 남
전기분해시 (-)극에서 수소 발생
리트머스종이는 청색에서 적색으로 변색됨
- 산화물의 종류
산성 산화물 : CO2, SO2, SO3, NO2, SiO2, P2O5
염기성 산화물 : CaO, CuO, BaO, MgO, Na2O, K2o, Fe2O3
양쪽성 산화물 : ZnO, Al2O3, SnO, PbO, Sb2O3
- pH=-log[H+]
- 산성용액에서 색깔을 나타내는 지시약 : MO, MR, TB
- 비점 상승, 빙점 강하
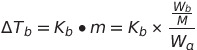
Wb/M은 용질의 mol수
Wa는 용매의 g수
- 소수콜로이드 : 물과의 친화력이 좋지 않고 소량의 전해질을 넣으면 침전이 일어나는 무기질 콜로이드로서 염화은 수산화알루미늄, 수산화철, 흙탕물, 먹물 등
- 용해도 = 용질g수/용매g수*100
- 기체의 용해도는 온도가 상승하면 감소하고, 압력이 상승하면 증가함
- 헨리의 법칙에 적용되는 기체 : H2, O2, N2, CO2
- ppm = mg/L = g/m^3 = mg/kg = 용액의 질량(mg) / 용액의 부피(L)
- 몰농도(M) : 용액 1L에 녹아 있는 용질의 몰수
- %농도를 몰농도로 환산시 M = 10ds/분자량
d는 비중, s는 %농도
- 노르말 농도(N) : 용액 1L 속에 녹아 있는 용질의 g 당량수 = 용액 1L 속에 들어있는 용질의 eq 수
- %농도를 노르말 농도로 환산시 N = 10ds/당량
d는 비중, s는 %농도
- 비전해질 : 수용액에서 전류가 통하지 않는 물질로 에탄올, 설탕, 포도당, 메탄올 등
- 산화 환원
산화 : 산소와 결합, 수소를 잃음, 전자를 잃음, 산화수 증가
환원 : 산소를 잃음, 수소와 결합, 전자를 얻음, 산화수 증가
- 산화제와 환원제
산화제 : 자신은 환원되고 다른 물질을 산화시키는 물질
환원제 : 자신은 산화되고 다른 물질을 환원시키는 물질
- 평형상수 : 평형상수 K는 생성물질의 속도의 곱을 반응물질의 속도의 곱으로 나눈 값
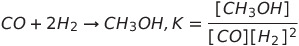
- 르 샤틀리에의 평형이동의 법칙
화학 평형에서 계의 상태를 결정하는 변수인 T,P,농도 등의 조건이 바뀌면 그 계를 완화시키는 방향으로 반응이 진행되어 새로운 평형에 도달함
농도, 부피/압력의 변화는 평형의 위치는 변화시키지만, 평형 상수 값에는 영향을 미치지 않음
하지만 온도의 변화는 평형 상수 값을 변하게 함
발열 반응일때 온도 증가 : 역반응 쪽으로 반응 진행
* 발열 반응 : 반응물 ⇌ 생성물 + Q 이므로 온도 증가시 열(생성물) 증가로 역반응 진행
흡열 반응일때 온도 증가 : 정반응 쪽으로 반응 진행
* 흡열 반응: 반응물 + Q ⇌ 생성물 이므로 온도 증가시 열(반응물) 증가로 정반응 진행
압력 상승 : 분자수가 감소하는 방향
* 압력 상승시 압력이 감소하는 방향인 분자수가 감소하는 방향으로 반응이 진행됨
- 분극현상의 감극제 : 이산화망가니즈(MnO2), 이산화납(PbO2)
- 전자 1몰당 전하량인 페러데이 상수 1F=96500C/mol
?C ( 전자1mol / 96500C )( 물질1mol / 전자 ? mol)( 물질 ?g / 물질 1mol ) = 물질 ?g
- 불꽃색상 : 칼륨(보라색), 나트륨(노란색)
- NaCl : 노란색의 불꽃반응을 하고 수용액에 AgNO3용액을 가하니 흰색침전이 생기는 물질
- 할로겐원소(7족) 반응성의 크기 : F > Cl > Br > I
반응성이 큰 원소가 이온으로 존재함
- 상방치환 : 공기보다 가벼운 기체를 포집하는 방법 (H2, CH4, NH3)
- 유기화합물의 관능기 : CH3-(메틸기), C2H5-(에틸기), C3H7-(프로필기), -CO(케톤기)
- 아이오도폼 반응 :분자 중에 CH3CH(OH)-나 CH3CO-(아세틸기)를 가진 물질은 I2와 KOH나 NaOH를 넣고 60~80도로 가열하면 황색의 아이오도폼(CHI3) 침전이 생김 (C2H5OH, CH3CHO, CH3COCH3 등)
- 벤젠(C6H6)에 불을 붙이면 H의 수보다 C의 수가 많기 때문에 그을음이 많음
- 벤젠의 유도체 : 톨루엔, o-자일렌, 클로로벤젠, 나이트로벤젠(니트로벤젠), 아닐린, o-크레졸, 에틸벤젠 등
* 유도체란 분자 구조 중의 일부분이 변화하여 생긴 화합물
- 펩티드결합 : 단백질 중에 펩티드결합을 말하며 나일론, 단밸질, 양모 아미드 등이 있음
'공부 > 【위험물산업기사】' 카테고리의 다른 글
| 【위험물 산업기사】 실기 2014년 기출문제(1) (0) | 2024.10.05 |
|---|---|
| 【위험물 산업기사】 필기 2과목 화재예방과 소화법 기출 정리 (0) | 2024.08.02 |
| 【위험물 산업기사】 필기 3과목 위험물의 성질과 취급 기출 모르는 문제 정리 (0) | 2024.07.31 |
| 【위험물 산업기사】 제1류~제6류 위험물 분류, 암기법 (0) | 2024.07.28 |
| 【위험물 산업기사】 필기 2과목 - 화재예방과 소화방법 주요 키워드 정리 (0) | 2024.07.28 |